酶促反应动力学
酶促反应动力学是研究酶促反应速度的规律以及影响酶促反应速度的各种因素。这些因素主要包括酶浓度、底物浓度、pH、温度、抑制剂和激活剂等。由于酶作为生物催化剂的特征就是加快化学反应的速度,因此,研究酶促反应的速度规律, 是酶学研究的重要内容之一;同时,在酶的结构与功能的关系以及酶作用机理的研究中,常需要动力学提供实验证据;在实际工作中为了使酶能最大限度地发挥其催化效率,亦需寻找酶作用的最佳条件;以及为了解酶在代谢中的作用或某些药物的作用机理时,需要研究酶促反应的速度规律。因此对酶促反应动力学的研究,具有重要的理论和实际价值。
一、底物浓度对反应速度的影响
(一)底物浓度对反应速度的关系
在其他因素,如酶浓度、pH、温度等不变的情况下,底物浓度的变化与酶促反应速度之间呈矩形双曲线关系(图3-1)。

图 3.1底物浓度对反应初速度的影响
从图中可以看出:
1.在底物浓度很低时,反应速度随底物浓度的增加而急骤上升,两者呈正比关系,表现为一级反应;
2.随着底物浓度的升高,反应速度不再呈正比例加快,反应速度增加的幅度变缓,表现为混合级反应;
3.如果继续增加底物浓度,反应速度不再增加,表现为零级反应。
此时,无论底物浓度增加多大,反应速度也不再增加。这说明酶已被底物所饱和。所有的酶都有饱和现象,只是达到饱和时所需的底物浓度各不相同而已。
(二)米氏方程
Michaelis和Menten在前人工作的基础上,经过大量的实验,1913年前后提出了反应速度和底物浓度关系的数学方程式,即著名的米曼氏方程(Michaelis-Menten equation),简称米氏方程.
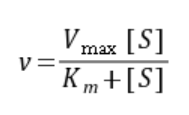
式中Vmax为最大反应速度(maximum velocity),[S]为底物浓度,Km为米氏常数(Michaelis constant),ν是在不同[S]时的反应速度。
当底物浓度很低([S]<<Km)时, ,反应速度与底物浓度成正比。
,反应速度与底物浓度成正比。
当底物浓度很高([S]>>Km)时,ν≈Vmax,反应速度达到最大速度,再增加底物浓度也不再影响反应速度。
(三)Km与Vmax的意义
(1)当酶促反应速度为最大速度的一半,即v = Vmax/2时,米氏方程式可以变换为:
进一步整理得Km=[S]。由此可见,Km值等于酶促反应速度为最大速度一半时的底物浓度。它的单位是mol/L。当pH、温度和离子强度等因素不变时,Km是恒定的。
(2)Km是酶的特征性常数之一,在酶学及代谢研究中是重要的特征数据。
Km值的大小,可以近似地表示酶和底物的亲和力,Km值大,意味着酶和底物的亲和力小,反之则大。因此,对于一个专一性较低的酶,作用于多个底物时,不同的底物有不同的Km值,具有最小的Km或最高的Vmax/Km比值的底物就是该酶的最适底物或称天然底物。
催化可逆反应的酶,当正反应和逆反应Km值不同时,可以大致推测该酶正逆两向反应的效率,Km值小的底物所示的反应方向应是该酶催化的优势方向。
③ 有多个酶催化的连锁反应中,如能确定各种酶Km值及相应的底物浓度,有助于寻找代谢过程的限速步骤。在各底物浓度相当时,Km值大的酶则为限速酶。
④ 判断在细胞内酶的活性是否受底物抑制。
⑤ 测定不同抑制剂对某一酶Km及Vmax的影响,可以用于判定该抑制剂是竞争性抑制剂还是非竞争性抑制剂。
必须指出,米氏方程只适用于较为简单的酶促反应过程,而对于比较复杂的酶促反应过程,如多酶体系、多底物、多产物、多中间物等,还不能全面地以此加以概括和说明,必须借助于复杂的计算过程。
二、酶浓度对反应速度的影响
在一定的温度和pH条件下,当底物浓度大大超过酶的浓度时,酶的浓度与反应速度呈正比关系,见图3-2。
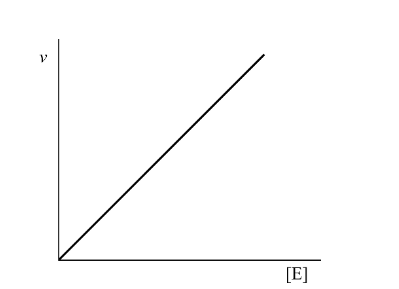
图 3.2 酶浓度对反应速度的影响
三、pH对反应速度的影响
(1)酶分子的结构发生变化 酶反应介质的pH可影响酶分子的结构,特别是活性中心内必需基团的解离程度和催化基团中质子供体或质子受体所需的离子化状态。
(2)影响底物和辅酶的解离程度 从而影响酶与底物的结合。
只有在特定的pH条件下,酶、底物和辅酶的解离状态,最适宜于它们相互结合,并发生催化作用,使酶促反应速度达到最大值,这时的pH称为酶的最适pH(optimum pH)。
举例:动物体内多数酶的最适pH接近中性,但也有例外,如胃蛋白酶的最适pH约为1.8,胰蛋白酶约为8左右(图3-3),而肝精氨酸酶则约为9.8。
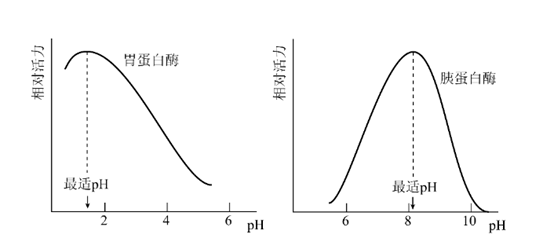
图 3.3 pH对酶活性的影响
四、温度对反应速度的影响
(1)在一定的温度范围内,随温度增高,反应速度加快。但酶是蛋白质,温度过高会使酶变性失活。在温度较低时,前一影响较大,反应速度随温度升高而加快。
(2)酶的最适温度 一般地说,温度每升高10℃,反应速度大约增加一倍。但温度超过一定数值后,酶受热变性的因素占优势,反应速度反而随温度上升而减缓,形成倒U形曲线。在此曲线顶点,酶促反应速度最大,此时的温度,称为酶的最适温度(optimum temperature)。
从动物组织提取的酶,其最适温度多在35~40℃之间,温度升高到60℃以上时,大多数酶开始变性,80℃以上,多数酶的变性不可逆。酶的活性虽然随温度的下降而降低,但低温一般不破坏酶,温度回升后,酶又恢复活性。
应用:生物制品、细菌菌种以及精液的低温保存, 即是基于这样的原理。
五、抑制剂对反应速度的影响
1.抑制剂(inhibitor) 凡能使酶的活性下降而不引起酶蛋白变性的物质称为酶的抑制剂。
抑制剂通常对酶有一定的选择性。一种抑制剂只能引起某一类或某几类酶的抑制。抑制剂虽然可使酶失活,但它并不明显改变酶的结构。也就是说,酶并未变性,去除抑制剂后,酶活性又可恢复。
凡是使酶变性失活(称为酶的钝化)的因素如强酸、强碱等,其作用对酶没有选择性,不属于抑制剂。
2. 根据抑制剂与酶分子之间作用特点的不同,通常将抑制作用分为可逆性抑制和不可逆性抑制两类。
(1)不可逆抑制作用
不可逆抑制作用(irreversible inhibition)的抑制剂,通常以共价键方式与酶的必需基团进行结合,一经结合就很难自发解离,不能用透析或超滤等物理方法解除抑制。其实际效应是降低反应体系中有效酶浓度。抑制强度取决于抑制剂浓度及酶与抑制剂之间的接触时间。
按其作用特点,不可逆抑制又有专一性及非专一性之分。
①专一性不可逆抑制
此类抑制剂专一地与酶的活性中心或其必需基团共价结合,从而抑制酶的活性。
例如:有机磷杀虫剂能专一地作用于胆碱酯酶活性中心的丝氨酸残基,使其磷酰化而破坏酶的活性中心, 导致酶的活性丧失。
有机磷杀虫剂的杀虫机理:当胆碱酯酶被有机磷杀虫剂抑制后,胆碱能神经末稍分泌的乙酰胆碱不能及时分解,过多的乙酰胆碱会导致胆碱能神经过度兴奋,使昆虫失去知觉,人和家畜产生多种严重中毒症状,甚至死亡。
酶的活性恢复:有机磷杀虫剂可用含有-CH=NOH基的肟化物,或羟肟酸R-CHNOH衍生物将其从酶分子上取代下来,使酶的活性恢复。上述反应过程见图3-4。
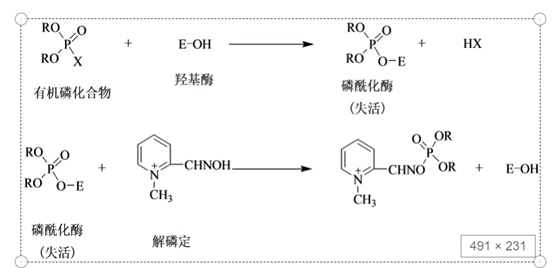
图 3.4 羟基酶的失活与恢复
②非专一性不可逆抑制
此类抑制剂可与酶分子结构中一类或几类基团共价结合而导致酶失活。它们主要是一些修饰氨基酸残基的化学试剂,可与氨基、羟基、胍基、巯基等反应。
例如:烷化巯基的碘代乙酸、某些重金属(Pb2+、Cu2+、Hg2+)及对氯汞苯甲酸等,能与酶分子的巯基进行不可逆结合。
酶的复活:用二巯基丙醇或二巯基丁二酸钠等含巯基的化合物可使酶复活。图3-5所示为巯基酶的失活与恢复。
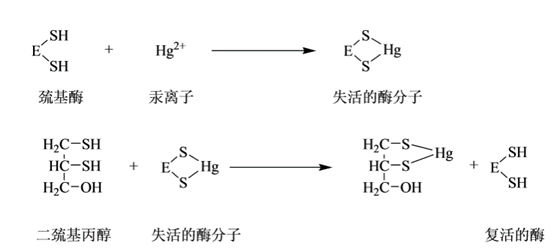
图 3-5 巯基酶的失活与恢复
(2)可逆性抑制作用
可逆性抑制作用(reversible inhibition)的抑制剂与酶的结合以解离平衡为基础,属非共价结合,用超滤、透析等物理方法除去抑制剂后,酶的活性能恢复。即抑制剂与酶的结合是可逆的。
这类抑制大致可分为竞争性抑制、非竞争性抑制、反竞争性抑制和混合抑制等。
重点讲述竞争性抑制和非竞争性抑制。
① 竞争性抑制作用:此类抑制剂一般与酶的天然底物结构相似,可与底物竞争酶的活性中心,从而降低酶与底物的结合效率,抑制酶的活性。这种抑制作用称竞争性抑制作用(competitive inhibition)。
例如:丙二酸、苹果酸有与琥珀酸相似的结构,它们是琥珀酸脱氢酶的竞争性抑制剂。
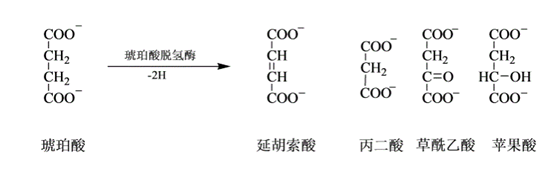
图 3.6 琥珀酸脱氢酶竞争性抑制剂
特征:a.由于抑制剂与酶的结合是可逆的,抑制强度的大小取决于抑制剂与酶的相对亲和力以及抑制剂与底物浓度的相对比例。
b.通过增加底物浓度可降低或消除抑制剂对酶的抑制作用。
竞争性抑制在实际生活中的应用:
竞争性抑制作用的原理可用来阐明某些药物的作用原理和指导新药合成。磺胺类药物是典型的例子。
许多抗癌药物,如氨甲蝶呤(MTX)、5-氟尿嘧啶(5-FU)等,几乎都是酶的竞争性抑制剂,它们分别抑制四氢叶酸、脱氧嘧啶核苷酸及嘌呤核苷酸的合成,从而抑制肿瘤的生长。
② 非竞争性抑制作用 有些抑制剂可与酶活性中心以外的必需基团结合,但不影响酶与底物的结合, 酶与底物的结合也不影响酶与抑制剂的结合,但形成的酶-底物-抑制剂复合物(ESI)不能进一步释放出产物,致使酶活性丧失。这种抑制作用称为非竞争性抑制作用(non-competitive inhibition)。
六、激活剂对酶促反应速度的影响
(1)激活剂(activator) 凡能使酶由无活性变为有活性或使酶活性提高的物质,通称为激活剂。
(2)激活剂(activator)种类
大部分是无机离子或简单的有机小分子。
① 如Mg2+是多种激酶和合成酶的激活剂;
② Cl-是唾液淀粉酶最强的激活剂。
③ 一些小分子有机物,如抗坏血酸、半胱氨酸、还原型谷胱甘肽等,对某些巯基酶具有激活作用。
这是由于这些酶需要其分子中的巯基处于还原状态才具有催化作用。还有些酶的催化作用易受某些抑制剂的影响,能除去抑制剂的物质也可称为激活剂,如乙二胺四乙酸(EDTA)。它是金属螯合剂,能除去重金属离子,从而解除重金属对酶的抑制作用。
--------------------------------------------------------
作者:一点通教育
链接:https://wenku.baidu.com/view/13b35d3c0a12a21614791711cc7931b765ce7b88.html
来源:百度文库
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。

